Neuigkeiten
Erfahrungen mit Langzeitantibiose bei Spätborreliose u. Argumente dafür – Erkenntnisse über Biofilme als mögliche Ursache chronischer Infektionen
Referat anlässlich der Frühjahrstagung der Deutschen Borreliose-Gesellschaft, Schweinfurt, April 2012
Wolfgang Klemann
Für die Behandlung der chronischen Lyme-Borreliose und relevanter Co-Infektionen liegen keine evidenzbasierten Studien vor, die Empfehlungen der verschiedenen Fachgesellschaften stützen sich ausschließlich auf Expertenmeinung. Es gibt also derzeit keine befriedigenden Standards für die Behandlung der chronischen Borreliose und relevanter Co-Infektionen; dies gilt im Besonderen fürPatienten, bei welchen eine antibiotische Kurzzeittherapie keine wirkliche Genesung brachte.
Vor 17 Jahren, als ich zum ersten Mal mit einem schweren Fall von Neuroborreliose (einer Plexusneuritis) konfrontiert war, waren die Empfehlungen zur Therapie auch schon kontrovers. Joseph Burrascano (1) war einer der wenigen Autoren, der damals antibiotische Langzeit-Therapie empfahl.
Um bei genanntem schweren Fall von Neuroborreliose zu bleiben: Anlässlich der damals notwendig gewordenen Stationierung wurde seitens der Klinik ein Cephalosporin-Antibiotikum (Cefotiam \Spizef) über drei Wochen intravenös appliziert, worunter es zu einem weitgehend vollständigen Rückgang schwerster neuralgiformer Schmerzen kam; unbefriedigend zurückgebildet zeigten sich aber begleitende chronische Müdigkeit, nächtliches Frieren u. schnelle Erschöpfbarkeit. Ziemlich genau ein Jahr später dann Auftreten eines Rezidivs der ursprünglichen Plexusneuritis. Wiederum kam es unter intravenöser Gabe eines Cephalosporins - diesmal Ceftriaxon - innerhalb von 10 Tagen zum Rückgang der neuralgiformen Schmerzen, wiederum aber nicht zum Rückgang der schweren Erschöpfung. Erst nach wiederholten mehrmonatigen Therapiezyklen unter Einsatz unterschiedlicher Antibiotika (Doxycyclin, Azithromycin) konnte schließlich auch befriedigender Rückgang der schweren Erschöpfung und chronischen Müdigkeit erreicht werden.
In den darauf folgenden Jahren sah ich Patienten, welche nach Zeckenstich mit nachfolgendem Erythema migrans anhaltende Symptome wie Gelenkschmerzen, Nackenschmerzen, Kopfschmerzen, Benommenheit, Erschöpfung usw. entwickelten, jedoch keine Borreliose-Antikörper. Dies war der Anlass, bei diesen Patienten nicht nur nach Antikörpern gegen Borrelia burgdorferi (Bb), sondern auch nach dem Erreger direkt zu fahnden, zumal zu dieser Zeit DNA-Analyse und kulturelle Anzucht des Erregers aus Körperflüssigkeiten, aber auch Hautbiopsaten als diagnostische Methode von einigen Laboren angeboten wurden. Resultat dieser erweiterten Diagnostik ist eine retrospektive Fallbetrachtung (2), über welche ich bereits vor 4 Jahren an dieser Stelle berichtet habe.
- Gegenstand dieser eigenen retrospektiven Studie sind 105 Patienten, die mit dem klinischen Verdacht auf eine chronische Lyme-Borreliose die Praxis aufsuchten.
- Es wurden die Auswirkungen längerer antibiotischer Therapie-Zyklen bei Patienten untersucht, bei welchen z.T. Jahre zuvor eine Kurzzeittherapie von wenigen Wochen erfolgte, ohne dadurch beschwerdefrei zu werden. In Hautbiopsaten und Gelenkpunktaten konnte der Erreger jedoch weiter nachgewiesen werden. Es schien daher gerechtfertigt, auf eine weiter bestehende Borrelieninfektion zu schließen. Gleichartige Ergebnisse werden auch von Preac-Mursic et al. in einer 1989 veröffentlichten Studie berichtet (3).
Erreger-Direkt-Nachweis erfolgte mit Hilfe der Bestimmung von
Borrelien-DNA mittels Polymerase Chain Reaction (PCR) und/oder
durch kulturelle Anzucht des Erregers und/oder durch
Visualisierung des Erregers mittels Immunfluoreszenzmikroskopie in „Focus floating microscopy“ -Technik (ab 2007, Universitäts-Hautklinik Innsbruck) (4).
Ausgewertet wurden die Daten von 90 Patienten, welche in meiner Praxis auch behandelt wurden – die übrigen 15 Fälle waren nur zur konsiliarischen Untersuchung vorstellig. Behandlungsziel bei diesen Patienten mit chronischer Lyme-Borreliose war die Besserung oder Beseitigung des Krankheitszustandes durch eine antibiotische Langzeitbehandlung.
Behandlungsergebnisse: 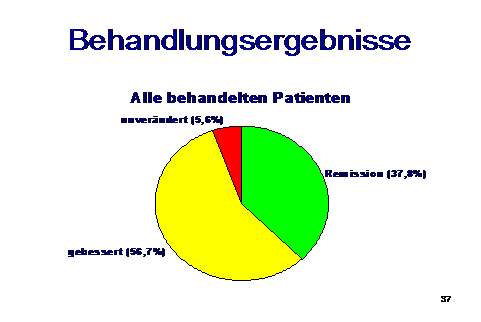
Es zeigte sich, dass auch bei Patienten mit jahre- bis jahrzehntelanger Vorgeschichte totale Beschwerdefreiheit erreichbar war, und dies immerhin in 37% der Fälle.
In 56% der Fälle konnte befriedigende Beschwerdebesserung erreicht werden, aber trotz monatelanger Behandlung kam es bei diesen Fällen noch zu Rezidiven, wobei durch jeweils neuerliche 3-4-wöchige Antibiose jeweils wieder Besserung erzielt werden konnte.
Im Verlauf kam es auf diese Weise zu immer längeren Perioden weitgehender Beschwerdefreiheit. 5-6 % der behandelten Fälle erwiesen sich als therapieresistent.
Insbesondere zu Beginn einer jeweiligen Behandlung erwies sich die intravenöse Applikation von Antibiotika (soweit von der Präparate-Zubereitung möglich) als notwendig; unter lediglich oraler Antibiotika-Gabe war insbesondere bei Patienten mit jahrelanger Vorgeschichte in aller Regel kein Genesungsfortschritt erreichbar. Bei vielen Patienten erwies sich die intravenöse Applikation gut verträglich, hingegen die orale Antibiotika-Gabe oft weniger gut. Dies gilt insbesondere für Doxycyclin, aber auch für Metronidazol.
Wichtige Erkenntnis dieser retrospektiven Studie: Auch bei Patienten mit jahrzehntelangem Krankheitsverlauf und vielfältiger Beschwerdesymptomatik gelang es durch eine bevorzugt intravenös applizierte antibiotische Langzeitbehandlung weitgehend beschwerdefreie Intervalle von 3-5 Jahren zu erzielen - in vielen Fällen auch länger – wie sich nun im weiteren Beobachtungszeitraum gezeigt hat. Die Behandlungsdauer betrug minimal 6 Monate, maximal 6 Jahre bei intermittierender Antibiotika-Gabe.
Der Nachweis von Bb (DNA-Analyse und/oder positive Kultur aus Vollblut) bei vorbehandelten Patienten mit disseminierter Lyme-Borreliose (165 Fälle) wird auch von J. Oksi et al. berichtet (5). Von dieser Autorengruppe wurde bei Erregernachweis trotz vorausgehender Antibiose bevorzugt Ceftriaxon über erneut 4-6 Wochen appliziert. Der Erfolg dieser Wiederholungsbehandlung wurde bei 9 von 13 Rezidiv-Patienten als gut erachtet, bei den übrigen 4 aber nicht ausreichend. Die Autoren schließen, dass auch eine Behandlung von über drei Monaten nicht in allen Fällen zu einer Eradikation von Spirochäten führt.
Während ich vor 10-15 Jahren überwiegend antibiotische Monotherapie praktizierte, habe ich im Verlauf der letzten 5 Jahre mehr u. mehr Antibiotika-Kombinationen eingesetzt, einerseits, weil ich bemerkt habe, dass damit schnellerer Genesungsfortschritt erreichbar war, andererseits aus Erkenntnissen der Grundlagenforschung. Wichtige Gründe, die für Kombinations-Antibiose sprechen: es hat sich gezeigt, dass der Erreger neben der spiraligen Form in weiteren Erscheinungsformen vorkommen kann – und dies nicht nur in der Kultur, sondern auch im Gewebe.
Die Stichworte dazu lauten: Zystische Form von Bb (6), Granuläre Form von Bb (6), und Zellwandlose Form von Bb (7)
Von der bereits zitierten Arbeitsgruppe um Prof. Zelger der Universitätshautklinik Innsbruck konnte gezeigt werden, dass die spiralige neben der cystischen Form von Bb beim Borrelien-Lymphocytom in Hautgewebe nebeneinander vorkommt. Bei Acrodermatitis-Patienten ergaben sich Befunde, bei welchen überwiegend die granuläre Form von Borrelia burgd. gefunden wurde.
Diese weitgehend stoffwechselinaktiven Formen werden durch übliche Antibiotika jedoch nicht getroffen. Nur wenige Substanzen bzw. Substanzgruppen zielen auf diese „Schläferformen“ und nur diese können diese stoffwechselinaktiven Formen treffen.
Eine weitere wichtige Erkenntnis, welche von Martin Sievers u. Priska Keller (8) mitgeteilt wird: „Borrelien sind in der Lage intrazellulär zu wachsen und konnten in
menschlichen Endothelzellen, in neuronalen Zellen und in Synovialgewebe nachgewiesen werden.
All die genannten Punkte erscheinen mir aber für die Medikamentenauswahl sehr wichtig.
Eine sehr differenzierte Darstellung gegen Bb wirksamer Antibiotika findet sich bei Walter Berghoff (9). Als wirksam erachtete Antibiotika werden hier unter den Kriterien
„Intrazelluläre Wirksamkeit“,
„Liquorgängigkeit“,
„Wirksamkeit auf zystische Formen“ u.
„Plasmahalbwertzeit“ aufgelistet.
Wirksame Antibiotika bei Lyme-Borreliose
Antibiotikum |
intrazellulär |
liquorgängig |
wirksam auf zystische Formen |
Plasma-halbwertzeit |
Betalactame Ceftriaxon |
- - - - |
(+)* + + - |
- - - - |
8 Std 40 Min 3 Tage 1 Std |
Tetracycline Doxycyclin |
+ |
(+) 14% |
- |
15 Std |
Makrolide Clarithromycin
Telithromycin |
+
+ |
-(2-5%)
- |
-
- |
4 Std |
Gyrase-Hemmer Gemifloxacin Tinidazol**
Tygecyclin*** |
+ +
+ |
+ (20%) +
+ |
- +
+ |
>12 Std 10 Std |
|
|
|
|
|
Angabe der Wirkdauer (Plasmahalbwertzeit), der Liquorgängigkeit, der intrazellulären Wirkung und der Wirkung auf zystische Formen. Liquorgängigkeit: Liquor / Serum-Konzentration in %.
* Die Betalactame haben eine geringe Liquorgängigkeit, erreichen jedoch im Rahmen ihrer großen therapeutischen Breite Liquorkonzentrationen, die deutlich über der minimalen inhibitorischen Konzentration (MIC) liegen (vgl. 164).
** Tinidazol und Metronidazol wirken auf Biofilm (Tinidazol > Metronidazol, Kaur N et al, 2010 (unveröffentlicht)).
*** Tygecyclin gehört zur Klasse der Glycylcyclin-Antibiotika, in vitro hoch wirksam gegen Borrelien, ist liquorgängig, wirkt intrazellulär und auf zystische Formen und besitzt eine lange Plasmahalbwertzeit, klinisch bei LB noch nicht getestet (185, 186).
Diese Tabelle erscheint mir äußerst hilfreich bei der Medikamentenauswahl.
Es ist offensichtlich, dass ein Borreliose-Betroffener mit chronischer Verlaufsform – z.B. mit Acrodermatitis - nicht nur mit der spiraligen Form, sondern auch mit der cystischen u. granulären - evt. auch zellwandlosen - Form von Borrelia burgdorferi konfrontiert ist.
Für mich resultiert daraus die Notwendigkeit die gegen die cystische Form v. B.b. wirksamen Substanzen in einem Therapie-Regime auch zum Einsatz zu bringen.
Auch das Kriterium „Intrazelluläre Wirksamkeit“ eines Antibiotikums erscheint mir sehr wichtig.
Wenn wir beispielsweise die Beta-Lactam-Anitbiotika betrachten wird klar, daß Sie zwei wichtige Wirksamkeitskriterien nicht erfüllen: Sie sind nicht intrazellular wirsksam und sie wirken nicht auf die cystische Form des Erregers.
Letztlich resultiert aus diesen Überlegungen die von mir bevorzugte Kombiantionsantibiose; diese beinhaltet in aller Regel Hydroxychloroquin 0-0-200 mg oral, gefolgt von Doxycyclin 200 mg i.v.-0-100 mg oral oder einem Makrolidantibiotikum, gefolgt von Metronidazol 500 mg i.v.-0-500 mg oral.
Wirkmechanismen der einzelnen Substanzgruppen:
Metronidazol, aus derselben Substanzgruppe auch Tinidazol: jeweils DNA-Strangbruch;
Hydroxychloroquin: lysosomotrope Substanz, indirekte Wirkung über Änderung des intralysosomalen Säuregrades - und – mit ähnlichem Wirkmechanismus auch Artemisia annua (Extract aus dem einjährigen Beifuß) (lysosomotrope Substanz).
Genannte Substanzen werden in aller Regel entweder mit Protein-Synthese-Hemmern aus der Gruppe der Tetracycyline oder/und Makrolide kombiniert.
Auch eine Kombination von Metronidazol und Hydroxychloroquin mit Betalactamantibiotika, welche eigentlich Membran-Synthese-Hemmer darstellen, wurde von mir praktiziert, insbesondere in Fällen, bei welchen es unter Tetracyclinen und/oder Makroliden nicht zu einer Besserung kam.
Um die Verträglichkeit der einzelnen Substanzen für den Patienten besser abschätzbar zu machen, verordne ich die ausgewählten Präparate nicht gleichzeitig, sondern stufenweise.
In aller Regel beginne ich mit Hydroxychloroquin – alternativ auch mit Artemisia annua - gefolgt meist von Doxycyclin i.v., gefolgt von Metronidazol i.v. oder auch Tinidazol oral.
Weitere Erkenntnisse aus der Grundlagenforschung:
Die komplexen und mannigfaltigen Wechselwirkungen v. Bb mit Fasern des Bindegewebes bzw. mit Strukturen von Bändern u. Sehnen - und die dazu verfügbare Literatur - wurden von Kurt E. Müller in einem Übersichtsaufsatz (10) dargestellt. Demnach wachsen Borrelien bevorzugt auf oder in biologischen Substraten, indem sie extrazelluläre Matrix abbauen (11), sie besitzen Metalloproteasen, mit denen sie Kollagen auflösen können und sich damit als Mikrokolonien in Kollagenfasern ansiedeln können (12). Mit dieser Übersichtsarbeit hat Herr Kollege Müller das Phänomen „Biofilm“ bzw. Wachstum von Bakterien in biofilmartigen Formationen tangiert.
Die Beschäftigung mit dem Thema „Borreliose als klinische Entität“ und dem Thema „Biofilm“ als die bei weitem wichtigste Lebensweise vieler Mikroorganismen legen den Gedanken nahe, chronische Borreliose als Biofilminfektion aufzufassen, zumal der chronische Krankheitsverlauf dadurch gut erklärbar wird.
Mikroorganismen im Biofilm produzieren Signalmoleküle, durch deren Konzentrationsanstieg die Zelldichte kommuniziert wird. Man nennt dieses Phänomen „Quorum sensing“.
Quorum sensing ist die Fähigkeit von Einzellern, über chemische Kommunikation die Zelldichte der Population messen zu können. Sie erlaubt es den Zellen einer Suspension bestimmte Gene nur dann zu aktivieren, wenn eine bestimmte Zelldichte über- oder unterschritten wird. An sich stammt der Begriff „Quorum“ aus der Zeit des römischen Reiches und bezeichnete im Senat die für eine Abstimmung benötigte geringste Zahl an Mitgliedern.
Von Andreas Wieser u. Sören Schubert (13) wird in einer Arbeit vom August 2011 über Intra- und extrazelluläre Biofilme uropathogener E.coli-Bakterien berichtet.
Darin werden Biofilme definiert als eine strukturierte Gemeinschaft von Mikroorganismen, die sich mit einer selbst erzeugten polymerischen Matrix umhüllen, und an einer lebenden oder künstlichen Oberfläche adhärent sind.
Von diesen Autoren werden Biofilme als therapeutische Herausforderung gesehen, da die in ihnen eingeschlossenen Erreger eine starke Resistenz gegen verschiedenste Umwelteinflüsse aufweisen. Dies betrifft auch eine Resistenz gegen antimikrobielle Chemotherapeutika und Abwehrmechanismen des Wirts während einer Infektion.
Ein Biofilm als besondere Erscheinungsform von Bb konnte von der Forschergruppe um Prof. Eva Sapi (14) durch unterschiedliche Mikroskopierarten charakterisiert werden: Zitat/Übersetzung aus dieser Verlautbarung:
"Unter den optischen Mikroskopiertechniken wurde die Dunkelfeldmikroskopie herangezogen, um die Interaktion peripherer Spirochäten mit dem Biofilm zu beobachten. DIC-Mikroskopie (Differentielle Interferenzkontrast-Mikroskopie) zeigte die Heterogenität der Biofilmmatrix auf. Fluoreszenzmikroskopie erlaubte die Beobachtung der sessilen internen Biofilmpopulation in einer GFP (Green Fluoreszenz Protein) -exprimierenden Population. Eine relativ neue Technik, die Rasterkraftmikroskopie (atomic force microscopy), wurde eingesetzt, um die Topographie von Biofilmen direkt zu scannen. Die Fähigkeit von B. burgdorferi eine biofilmartige Morphologie anzunehmen, könnte (teilweise) die anhaltenden Beschwerden bei chronisch Erkrankten erklären. Der Borrelia burgdorferi- Biofilm bietet vermutlich ein Rückzugsgebiet für Borrelien im Laufe der chronischen Infektion, bietet aber auch einen zusätzlichen Angriffsweg für potentielle Behandlungen der Borreliose."
Weitere Erkentnisse ergeben sich aus folgendem Beitrag derselben Arbeitsgruppe (15):
Zitat/Übersetzung aus dieser Verlautbarung:
„Unsere Überlegungen führten zu der dringende Vermutung, dass B. burgdorferi fähig ist, sich in einer selbst generierten protektiven Schicht, dem sogenannten Biofilm zu verstecken. Der Hauptzweck der Biofilmstruktur besteht darin, es Mikroben zu ermöglichen unter diversen Umweltstressoren, inklusive der Präsenz von angreifenden Immunzellen oder antibakteriellen Substanzen, zu überleben. Während konventionelle Antibiotika-Therapie sich in aller Regel effektiv gegen frei vorkommende Bakterien erweist, ist sie häufig ineffektiv, wenn Krankheitserreger Biofilme ausgebildet haben, denn Bakterien-Kolonien in Biofilmen können sich bis zu 1000 mal resistenter gegenüber Antibiotika erweisen. Um Borrelia burgdorferi- Biofilme zu verhindern und zu zerstören, brauchen wir ein besseres Verständnis der molekularen Mechanismen, die sich während der Bildung eines Biofilmes abspielen. In diesem Projekt haben wir uns dafür entschieden, spezifische genetische Marker, welche die Kommunikation in Biofilmen regulieren – so genannte „Quorum sensing- Faktoren“ – zu überwachen bzw. zu monitoren. ……Unsere Ergebnisse zeigen, dass die Regulation der genannten Quorum sensing Gene sich dynamisch darstellt und exzellente Marker darstellen, um die Entwicklung von Borrelia burgdorferi-Biofilmen beurteilen bzw. monitoren zu können“.
In einer Arbeit von Kristen Kerksiek (16) finden sich die folgenden Mitteilungen zum Thema Resistenz gegen mikrobenhemmende Wirkstoffe:
„Mikroorganismen in Biofilmen unterscheiden sich von ihren frei lebenden Verwandten: Sie exprimieren besondere Gene, haben je nach ihrer Position innerhalb des Biofilms einen sehr heterogenen Stoffwechsel und stehen in engem Kontakt, was die Genübertragung erleichtert. Die extreme Antibiotikaresistenz der Biofilme - sie sind bis zu 1000 mal resistenter als frei lebende Bakterien des gleichen Stammes - hat uns kalt erwischt, aber eigentlich hätten wir uns darüber vielleicht nicht wundern sollen: Antibiotika werden nicht an Biofilmen erprobt, sondern an (frei vorkommenden) Planktonbakterien.
Dass Biofilme gegenüber einer Behandlung mit Antibiotika so widerstandsfähig sind, dürfte unter anderem daran liegen, dass der Zutritt der Wirkstoffe erschwert ist. Wichtiger als die physische Barriere der Exopolymere im Biofilm scheint jedoch ihre strukturelle Heterogenität zu sein: Sie sind enthalten in Nischen, in denen die Mikroorganismenpopulationen wegen der niedrigen Sauerstoff- und Nährstoffkonzentration nur eine geringe Stoffwechselaktivität aufweisen, und in einem solchen Ruhezustand sind Bakterien relativ resistent gegen Antibiotika. Durch eine Antibiotikabehandlung werden die Bakterien in den äußeren Schichten des Biofilms, wo eine höhere Stoffwechselaktivität herrscht, vielleicht abgetötet, aber schon wenige "hartnäckige" Zellen können den Biofilm nachwachsen lassen, sobald die Behandlung abgesetzt wird; in der äußeren Wand des Biofilms, der die Mikroorganismen im Inneren abschirmt, werden Individuen geopfert, damit die Gemeinschaft überlebt. Solche hartnäckigen Varianten (im Gegensatz zu Mutationen oder der Ausbreitung eines Resistenzgens) scheinen für die Antibiotikaresistenz der Biofilme der wichtigste Faktor zu sein, denn die überlebenden Bakterien sprechen nach wie vor auf Antibiotika an. Das heißt, sie bleiben antibiotikaempfindlich, wenn sie es auch ursprünglich waren.“
In einer Arbeit von P. S. Stewart u. J W. Costerton (17) wird der Mechanismus der (Antibiotika)-Resistenz in Biofilmen diskutiert. Er unterscheidet sich von bekannten Mechanismen wie genetische Veränderungen durch Plasmide, Transposons und Mutation, welche individuellen Bakterienzellen eigene Resistenz verschaffen.
In Biofilmen scheint Antibiotika-Resistenz von multizellularen Strategien abzuhängen.
Beschrieben wird das „Phänomen des langsamen Eindringens“ des Antibiotikums. Das Antibiotikum schafft es nicht, über die äußere Schicht des Biofilms vorzudringen. Ein Teil der im Biofilm enthaltenen Bakterien können sich in einen geschützten Phänotyp verwandeln.
Des Weiteren wird das „Phänomen der veränderten Mikroumgebung“ genannt:
In Zonen von reduziertem Nahrungsangebot oder der Anhäufung von Stoffwechsel (Abfall)-Produkten kann es zu einer Antagonisierung von Antibiotika kommen.
Auf dem Hintergrund all dieser Erkenntnisse wird m. E. verständlich, warum manche Infektionen – Chronische Borreliose eingeschlossen - nicht leicht und schon gar nicht „schnell“, d.h. innerhalb weniger Wochen, wirklich erfolgreich zu behandeln sind.
In der bereits zitierten Arbeit von A. Wieser u. S. Schubert (13) wird auch über „Intrazelluläre Biofilme“ berichtet:
„Intrazelluläre Biofilme sind eine Entität, die vor allem beim Harnwegsinfekt eine Rolle zu spielen scheinen. Dabei handelt es sich um intrazelluläre replizierende und persisitierende Erreger, die sich durch diese Niesche vor den harschen Umweltbedingungen und dem Immunsystem des Wirts im Harntrakt schützen.“
Die intrazellulär beobachtete Verwandlung v. Bb in die „Granuläre Form“ dürfte dem Vorgang der Bildung eines intrazellulären Biofilms entsprechen (6). Die Behandlung eines intrazellulär abgesiedelten Erregers ist aber noch schwieriger als die Behandlung eines extrazellulär oder evtl. nur planktonisch vorkommenden Erregers.
Genannte Erkenntnisse über Biofilminfektionen ergeben aber auch Ausblicke auf neue therapeutische Optionen:
Zum Thema „Therapiemöglichkeiten“ findet sich wiederum bei Kristen Kerksiek (16):
„Mit Biofilmen im Labor zu arbeiten, ist schwierig, aber nachdem man erkannt hatte, wie wichtig sie im Zusammenhang mit Infektionskrankheiten sind, machte die Forschung viele Fortschritte. Ein großer Schritt war die Erkenntnis, dass die Bildung von Biofilmen ein genetisch programmierter Entwicklungsprozess ist; damit eröffnete sich die Möglichkeit, gezielt neue Chemotherapeutika zu entwickeln.
Für die Suche nach wirksamen Behandlungsmethoden für Biofilm-Infektionen gibt es verschiedene Strategien: Man kann beispielsweise verhindern, das die Bakterienzellen sich aneinander heften, oder man vermindert die Polysaccharidproduktion und stört die Zell-Zell-Kommunikation. Insbesondere die Entdeckung der Quorum-Sensing-Kommunikation gab den Anlass zu großen Hoffnungen, dass man mit neu entwickelten Wirkstoffen die Bildung von Biofilmen verhindern oder vorhandene Biofilme auflösen kann. „
Dies entspricht auch dem zitierten Ansatz von Eva Sapie u. ihrer Arbeitsgruppe (15).
Weitere Aspekte zum Thema „Therapiemöglichkeiten „ zitiert nach Kristen Kerksiek (16):
„ Biofilme aus Staphylococcus aureus kommunizieren beim Quorum Sensing mit autoinduzierenden Peptiden (AIPs). Horswill und Kollegen (18) synthetisierten solche Peptide und setzten sie vorhandenen Biofilmen von S. aureus zu. Diese lösten sich daraufhin sehr schnell auf, und die freigesetzten Bakterien sprachen wieder auf Antibiotika an.“
„Die schleimige extrazelluläre Matrix der Biofilme schützt die Mikroorganismen vor einer Fülle von Feinden, so vor dem Immunsystem, mikrobenhemmenden Wirkstoffen und den meisten Bakteriophagen (Viren, die Bakterien infizieren). Lu und Collins (19) konstruierten gentechnisch veränderte Bakteriophagen, die Schleim abbauende Enzyme ausscheiden und so ins Innere des Biofilms vordringen können. Dort zerstören sie den Biofilm weiter, indem sie die Enzyme in übergroßen Mengen produzieren und dann die Bakterien abtöten.“
Eine excellente Übersicht von auch in diesem Referat angesprochenen Erkenntnissen zum Thema „Borreliose als persistierende Infektion“ und aktuelle Forschungsrichtungen - Diagnose u. Therapie der Lyme-Borreliose betreffend - wurde von Raphael B. Stricker u. Lorraine Johnson (20) im Januar 2011 unter dem Titel „Lyme disease: the next decade“ veröffentlicht.
Literatur
1) Burrascano, J., Guidelines for Lyme and other tick borne Illnesses, Sixteenth Edition, 2008 Diagnostic hints and treatment, http://www.ilads.org/lyme_disease/B_guidelines_12_17_08.pdf
2) B.-D. Huismans, W. Klemann, Langzeitbehandlung mit Antiinfektiva bei persistierender Borreliose mit Borrelien-DNA-Nachweis durch PCR, Grin Verlag, 20.10.2008
3) Preac-Mursic, V. et al., Neurologische Klinik Grosshadern, München, Survival of Borrelia burgdorferi in antibiotically treated patients with Lyme borreliosis, Infection. 1989 Nov-Dec;17(6):355-9. http://www.ncbi.nlm.nih.gov/pubmed/2613324
4) Eisendle K., Grabner T., Zelger B. Focus floating microscopy: "gold standard" for cutaneous borreliosis? Am J Clin Pathol. 2007 Feb;127(2):213-22.
5) Oksi J., Marjamäki M., Nikoskelainen J., Viljanen MK. Borrelia burgdorferi detected by culture and PCR in clinical relapse of disseminated Lyme borreliosis. Ann Med. 1999 Jun;31(3):225-32.
6) Alan B. Mac Donald, MD, July 7, 2008 University of New Haven Lyme Disease Symposium New Haven, Conn. http://ww.molecularalzheimer.org/files/Biofilm_New_Haven_final_lecture.pdf
7) Lida H. Mattman, 3rd Edition, Cell Wall deficent forms Stealth Pathogens, CRC Press LLC, 2001
8) Martin Sievers und Priska Keller (2008), Bestimmung geeigneter Antibiotika gegen die Erreger der Lyme Borreliose im Zellkulturmodell http://bsg-sw.gmxhome.de/Sievers%20AB%20im%20Zellkulturmodell.pdf
9) Berghoff, W., Antibiotische Behandlung der Lyme- borreliose (LB), Umwelt-medizin-gesellschaft (22) 2/2009, ISSN 1437-2606, S. 125-131 http://www.praxis-berghoff.de/dokumente/Lyme_Borreliose_im_Ueberblick.pdf
10) Müller, K. E. (2009), Erkrankung der elastischen und kollagenen Fasern bei Lyme-Borreliose, umwelt · medizin · gesellschaft - 2/2009
11) Coleman, JL. et al. (1999), Plasmin-coated borrelia Burgdorferi degrades soluble and insoluble components of the mammalian extracellular matrix. Infect Immun (8): 3929-3936
12) Zambrano MC, et al. (2004) Borrelia burgdorferi binds to, invades, and colonizes native type I collagen lattices, Infect Immun.;72(6):3138-46.
13) Andreas Wieser und Sören Schubert (2011), Intra- und extrazelluläre Biofilme uropathogener E. coli , Chemother J 2011;20:181–5.
14) Luecke D.F. et al., (2009) Novel Fugitive Strategy for Borrelia burgdorferi: Biofilm http://www.lymeneteurope.org/forum/viewtopic.php?f=5&t=2776
15) Bien-Aim H. et al. (2011), Expression Profile of Quorum Sensing Biomarkers during Biofilm Development in Borrelia burgdorferi, http://www.lymeneteurope.org/forum/viewtopic.php?f=5&t=3468
16) Kerksiek K. (2008), Leben im Schleim: Biofilme beherrschen die Welt. http://www.infection-research.de/de/perspectives/detail/pressrelease/a_life_in_slime_biofilms_rule_the_world-2/
17) Philip S Stewart, J William Costerton, Antibiotic resistance of bacteria in biofilms, Center for Biofilm Engineering and Department of Chemical Engineering, Montana State University, Bozeman, USA; Lancet 2001; 358: 135–38
18) Blaise R. Boles, Alexander R. Horswill, agr-Mediated Dispersal of Staphylococcus aureus Biofilms, PLoS Pathog. 2008 April; 4(4)
19) Timothy K. Lu and James J. Collins, Dispersing biofilms with engineered enzymatic bacteriophage, PNAS July 3, 2007 vol. 104 no. 27 11197-11202
20) Raphael B. Stricker, Lorraine Johnson, International Lyme and Associated Diseases Society, Bethesda, MD, USA; Lyme disease: the next decade. Infection and Drug resistance, 6th January 2011
Nutzungsbedingungen und Haftungsausschluss
Nach dem Urteil vom 12. Mai 1998 – 312 O 85/98 – “Haftung für Links“, Landgericht (LG) Hamburg ergeht folgende Erklärung: Der Autor distanziert sich vorsorglich ausdrücklich von allen Inhalten der verlinkten externen Internetseiten und macht sich diese Inhalte nicht zu Eigen. Diese Erklärung gilt für alle angebrachten Links.
Der Beitrag kann einen Besuch beim Arzt keinesfalls ersetzen. Der Beitrag wurde mit der größten Sorgfalt erstellt. Für die Genauigkeit oder Richtigkeit der mitgeteilten Informationen kann der Autor die Verantwortung dennoch nicht übernehmen. Unter keinen Umständen ist der Verfasser des Beitrags für irgendwelche Verluste und/oder Schäden haftbar zu machen, die dem Nutzer dadurch entstehen könnte, dass er auf eine Information vertraut, die er im Rahmen der Nutzung des Beitrags erhalten hat.
Der Autor steht in keinem finanziellen Abhängigkeitsverhältnis. Dieser Beitrag wurde ohne finanzielle Zuwendung erstellt.